問題28 キレート滴定法による銅と亜鉛の定量 合金は、日々の生活の様々な場面で使用されている。とりわけ、その特性(たとえ ば伝導性,機械的特性あるいは耐食性など)により、合金は航空学,建実験問題2 キレート滴定とヨウ素還元滴定による 金属イオンの定量 (18 5 27, IChO50代表生徒強化訓練合宿@長崎大学) キレート滴定(錯滴定)とヨウ素還元滴定は,溶液中の金属イオンの定量方法として,代表的 な方法である。まで滴定する(ブロモクレゾールグリン試洷 2滴)。 アスピリンの定量 アスピリンの定量は,逆滴定に用いた硫酸について計算する。そのため,水酸化ナトリ ウムの量は計算には必要なく,操作中に溶け込んだ二酸化炭素は計算から除外される。
2
キレート滴定 計算問題
キレート滴定 計算問題-(分析化学I・3枚中の2枚目) 問題2 キレート滴定について、設問に答えよ。 問 A Cu2 を001 mol L–1 含み、酢酸-酢酸ナトリウム緩衝液でpH 5に調整 してある試料溶液100 mLに対して、001 mol L–1 エチレンジアミン四 酢酸(EDTA; すると、 滴定によって未知の濃度などを求めることが不可能になってしまいます 。 このような場合も存在するので、頭に入れておきましょう。 中和滴定の計算問題 では実際に計算問題の解き方と練習問題を見ていきましょう。



Tohtech Ac Jp
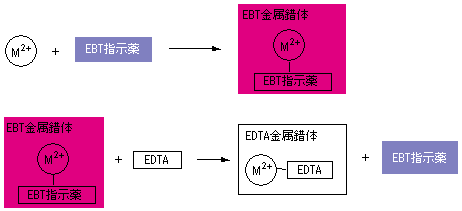
キレート滴定の濃度計算問題についてです。 解き方がわからないので、教えていただきたいです。 以下、問題内容です。 Ca2とMg2の混合溶液(以下Aとする) mLをとり,アンモニア−塩化アンモニウム緩衝液でpHを10とし,エリオクロムブラックT(EBT中和滴定曲線,中和点と半中和点,逐次錯形成,全安定度定数 第8回 キレート滴定(6/28) 錯体の安定性,キレート試薬,edta 第9回 キレートの環境分析での利用(7/5) 全硬度,吸光光度法,キレート抽出 第10回 沈殿生成平衡と沈殿滴定(7/12) キレート滴定の濃度計算問題についてです。 解き方がわからないので、教えていただきたいです。 以下、問題内容です。 Ca2とMg2の混合溶液(以下Aとする) mLをとり,アンモニア−塩化アンモニウム緩衝液でpHを10とし,エリオクロムブラックT(EBT
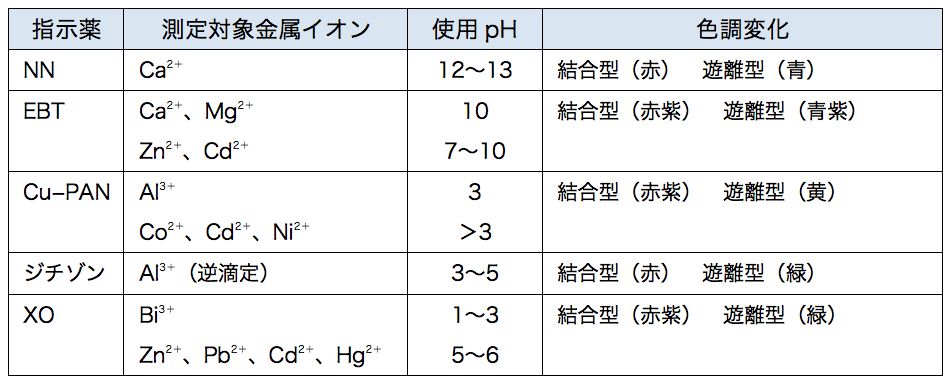
問題28 キレート滴定法による銅と亜鉛の定量 csj 4 ph 6 における h 2 edta 2 – のモル分率を計算しなさい。 edta は、次の酸解離定数を持 つ弱酸である。演習 (p71)/問題 34 難 <キレート滴定> EDTA液によるMgCl 2 の滴定(滴定時pMg) 演習(p86)/問題 15 EDTA標準液の標定(直接法) 演習 (p)/問題 8 EDTA標準液による亜鉛の滴定 CBT (p143)/問題 612 キレート滴定の金属指示薬 CBT (p144)/問題 613Nn指示薬 キレート滴定の指示薬(錯形成→ 赤:遊離→ 青) edta溶液 滴定剤 有機廃液タンクへ (注ぎ口にろ紙をつけておくこと!) 実験の注意事項 edta滴下 (1) 『ホールピペットで取る』と指定が無いものは大体でok!
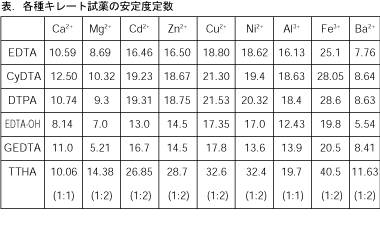
H4Y)溶液を(1)95 mL、(2)100 mL、(3)105 mLEDTA と金属キレートのK f 値→p18, 表12 <例:EDTA とMg2> K f = 49×108 log K f = 8 log 49 = 869 ML n M Ln 8 キレート滴定 多座配位子EDTA(標準液)が 金属イオン(Zn 2, Mg 2, Ca , Al3, Cu 等)と 水溶液中で安定な可溶性のキレート化合物を生成する ことを利用したキレート滴定および沈殿滴定に関する基礎理論を理解し、計算問題が解ける。 5 酸化還元滴定 (1)酸化還元滴定座学、溶液調製 4 酸化還元滴定の原理や特徴がわかる。また、各種溶液を正しく調製することができる。 (2)酸化還元滴定1 4



キレート滴定 Yakugaku Lab




滴定計算 滴定についてよくある質問 定義 モル濃度方程式 曲 Lorett
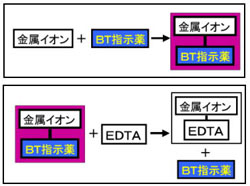
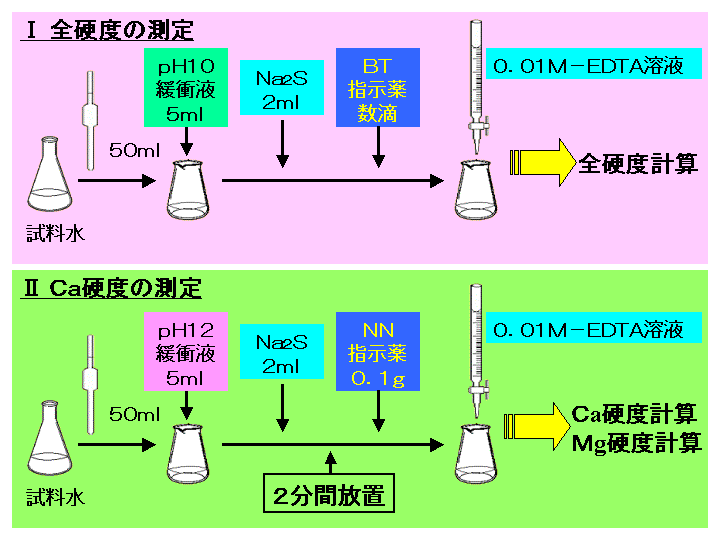
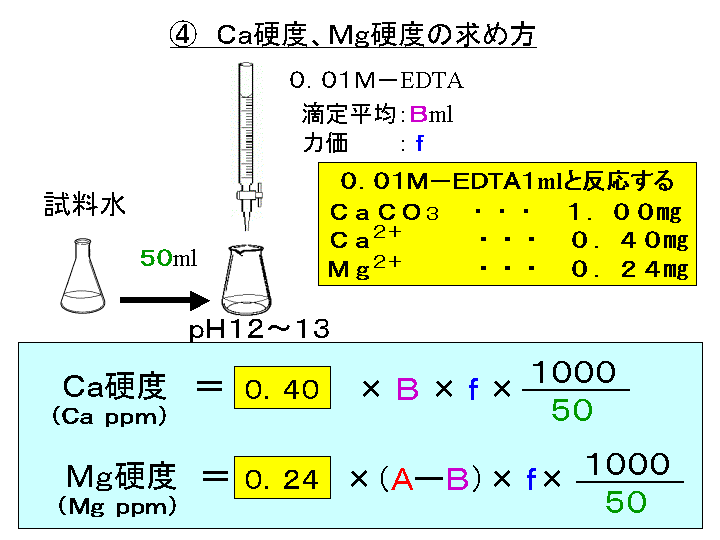
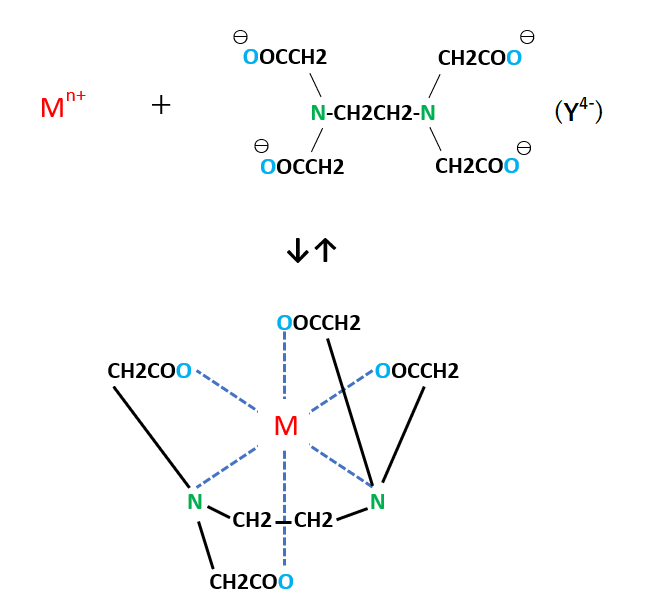
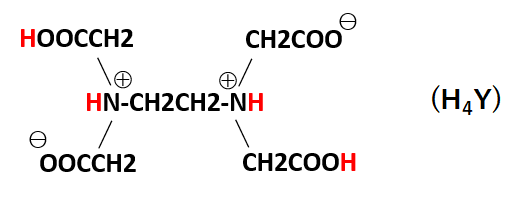
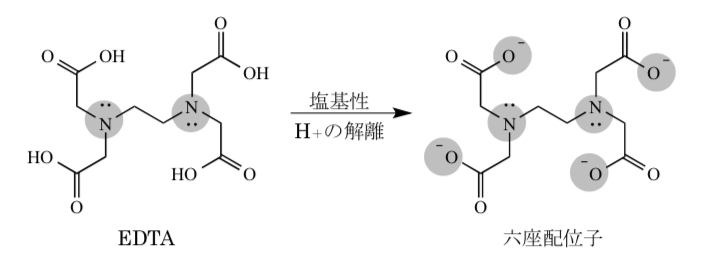
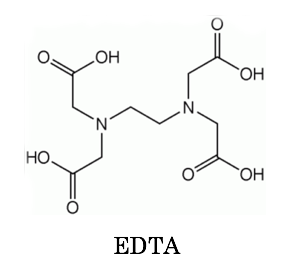
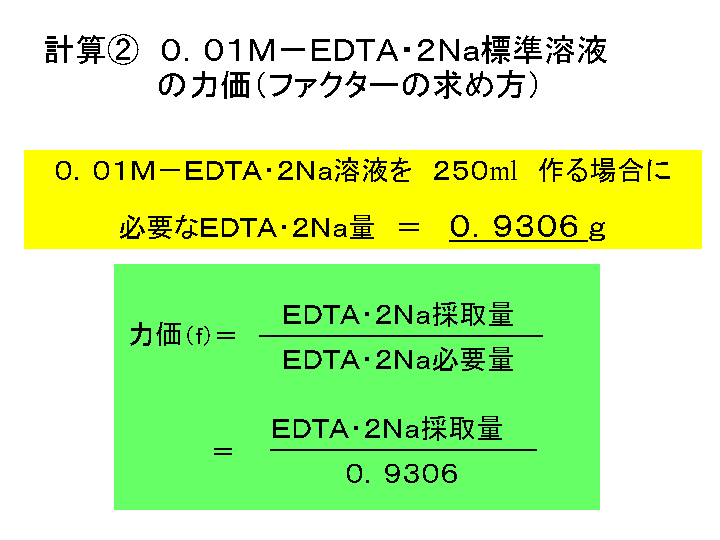
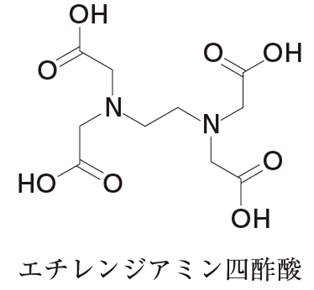
キレート滴定 エチレンジアミン四酢酸(edta、h 4 yと略記)は、水溶液中で金属イオンと反応し、 非常に安定な金属キレート化合物を作る。 キレート滴定は、そのことを利用した容量分析法である。キレート生成反応は、 である。水の硬度測定(キレート滴定) 0.01M-EDTA標準溶液で滴定 ← ビュレットに入れる ↓ (3回以上繰り返し) ↓ 全硬度の計算 ii Ca硬度の測定キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手



水の硬度測定 キレート滴定




キレート滴定 Yakugaku Lab
キレート滴定の原理、操作法および応用例を説明できる。 ②問題の解説講義の方を早い方が良いとの意見もあったので、演習の解説動画もその授業の時間内に出す予定です。 キレート滴定の対応量計算キレート滴定法は,金属キレート錯体の生成反応を利用して,金属イオン を定量する方法である。たとえば,水道水など飲料水中に含まれるマグネシ ウムおよびカルシウムイオン濃度,すなわち,水の硬度はedta を用いる キレート滴定によって簡単に測定レート滴定法の原理,そこで用い られる応用的な手法(逆滴定,置換滴定,マ スキングなど)につい て概説するとともに,これを用 い たい くつ かの金属イオンの定量法を紹介する。 1 は じめ に キレート滴定は,G, Schwarzenbach(シュ ヴァ ルツ ェ



キレート滴定の問題で Bt指示薬を使ってcaとmgの混合溶液のmgだけの濃度 Yahoo 知恵袋



水の硬度測定 キレート滴定
キレート滴定の諸問題と, 石灰石, ドロマイト露頭における化学成分の変動について 藤貫 正 , 藤谷 吉三 著者情報 藤貫 正 通商産業省地質調査所化学課 藤谷 吉三 通商産業省地質調査所化学課 ジャーナル フリー 1966 年 1966 巻 号 pキレート滴定の計算方法 1 試薬の体積と初濃度 塩化アンモニウムNH 4 Cl-アンモニア水NH 3 系のpH緩衝液により,常にpH=10一定であると仮定する.計算を簡単化するために,カルシウムイオンCa 2 やマグネシウムイオンMg 2 と指示薬のエリオクロムブラックT(EBT)の錯体形成反応(化学平 キレート滴定の問題です。よろしくお願いします。 質問日時: 21/6/3 1600 回答数: 1 閲覧数: 55 教養と学問、サイエンス > サイエンス > 化学 キレート滴定で脱イオン水を使う理由を教えてください。 カチオンがあると、滴定に影響するから。




容量分析法 キレート滴定 問題解説 Youtube



2
滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2水の硬度測定 1 はじめに 硬度 1) とは,水に含まれるCa 2 とMg 2 の量を表す指標であり,この値に基づいて軟水や硬水 2) といった水の硬さが決められている。 軟水は口当たりがまろやか,硬水は苦みのような口当たりといわれている。近年,スーパーなどで多くの種類のミネラルウォーターを錯形成平衡とキレート滴定(2) 8 キレート滴定の原理を理解し,金属イオン濃度に関する計算ができる. 14週 酸化還元平衡と酸化還元滴定(1) 9 ネルンスト式を用いて平衡電位に関する計算ができる. 15週 酸化還元平衡と酸化還元滴定(2) 10



水の硬度測定 キレート滴定



水の硬度測定 キレート滴定
示薬としてedta溶液で滴定し,edta溶液の正確な濃度を決定する。 4.キレート滴定によるca2+とmg2+の定量 試料水にph 10緩衝液を加え,edta溶液とebt指示薬を用いてキレート滴定を 行い,試料水に含まれるca2+とmg2+の合計量を定量する。(5) 滴定・終点操作 (ア) 手際よく滴定操作ができている。 (イ) 終点の判断が適切である。 3 完成度・結果について 1 報告書 (1) 反応式・計算式など必要なものが記入されている。 (2) 反応式に基づいた計算が正しくされている。 (3) 誤差を考慮している。各種滴定・イオン交換法 担当:反応分析化学 竹原takehara@chemkyushu公 24 電位差滴定法 担当:錯体物性化学 越山 @mboxnckyushu友美 42 第2分冊 九州大学理学部化




明治大 化学 農学部 大学入試分析web 進研ゼミ高校講座



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ
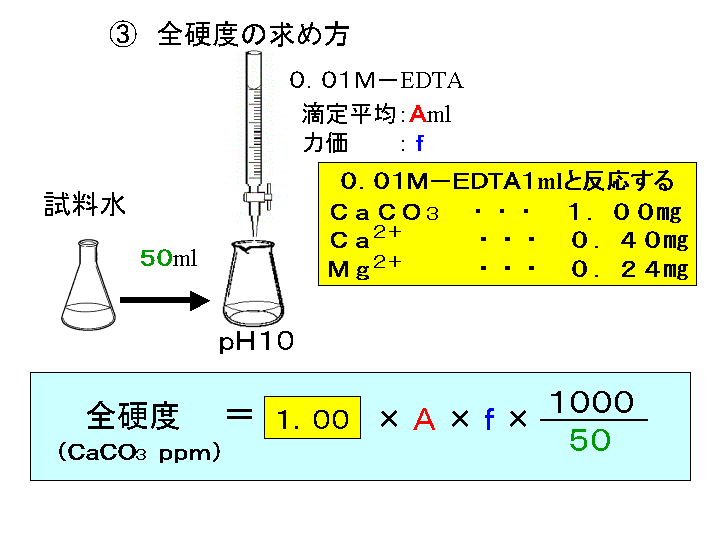
ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。1)の滴定量が正しいので、1) で計算した数値を基準にして他の 2) 及び 3) の結果と比較し ( ) キレート滴定の場合、滴定量は、001 ml の単位まで正確に読み取り、小数以下二桁目は四 即ち、上記問題のpH 3 の水素イオン濃度は、10-3(0001)mol/Lとなる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが




最も欲しかった キレート滴定 考察 書き方 キレート滴定 考察 書き方 Mbaheblogjpmvvo




応用化学科 バイオ 化学部 学部 6 カリキュラムガイド Campus Guide 21 Kit 金沢工業大学
物理 のページです。 yakuzeroは薬剤師国家試験のオンライン動画を 0円(zero)で視聴できるサイトです。どなたでもご利用できますので、「全国の薬学生の方が、薬剤師への道を諦めない」そんな日が来ることを願っております。(3)中和滴定2 4 乳酸菌飲料中の乳酸濃度を求め、併せて弱酸強塩基の 滴定曲線を作成できる。 (4)章末テスト、キレート滴定座 学 4 中和滴定に関する基礎理論を理解し、計算問題を解くこ とができる。 キレート滴定の原理や特徴がわかる。 4錯体・キレート 錯体平衡の計算問題を解いてみよう演習問題 ・錯体・キレート平衡の計算問題 その1 というテーマで解説していきます。 錯体・キレート平衡の計算問題 その1演習問題 それでは、頻出の錯体解離平衡に関する演習問題を解いてみ



2



2
3.edtaによるキレート滴定 競技では,edtaによるキレート滴定の原理やebt指示薬やnn指示薬を用いてca2+ やmg2+ を定量する具体的な方法を問題文の1,2ページに記載し,初学者にも充分理解で きるように配慮した。次に実験操作の手順を簡潔に示す。



化学 標準 理論化学 担当 犬塚 Juken7 Note




薬剤師国家試験予備校rec Explore Facebook



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



2




キレート滴定



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて




キレート滴定 薬学 これでok



2



Tohtech Ac Jp




最も欲しかった キレート滴定 考察 書き方 キレート滴定 考察 書き方 Mbaheblogjpmvvo



キレート滴定の濃度計算問題についてです 解き方がわからないので 教えていただ Yahoo 知恵袋



ひたすら受験問題を解説していくブログ東京大学12年前期化学第2問ii
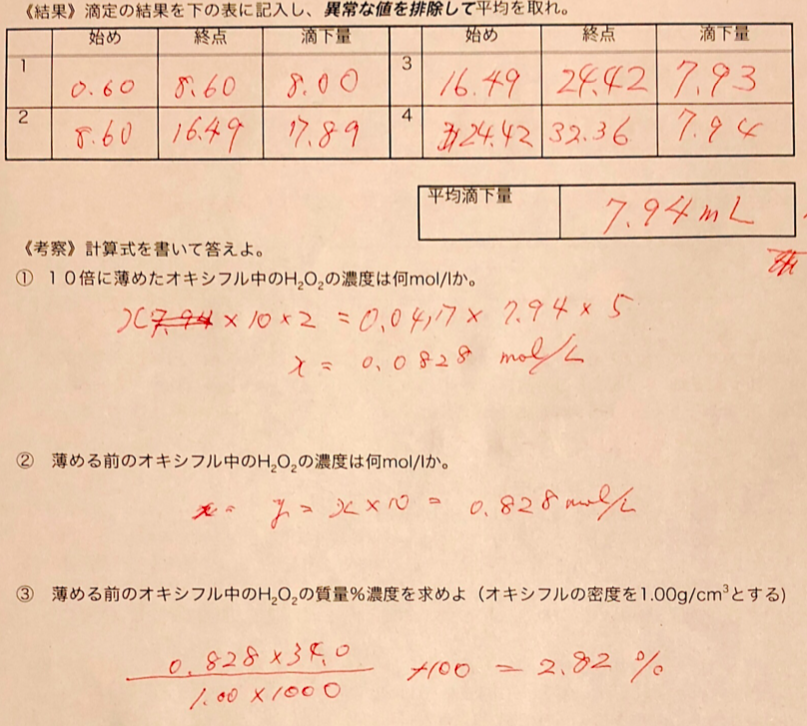



上 キレート滴定 考察 キレート滴定 カルシウム 考察



薬剤師国家試験 第105回 問92 過去問解説 E Rec わかりやすい解説動画



2



Edtaを用いた硬度計算の問題があります カルシウムイオン マグ Yahoo 知恵袋



2




水の硬度測定 キレート滴定




薬学生のための計算問題集 薬ゼミ流 計算革命 メルカリ



ひたすら受験問題を解説していくブログ東京大学12年前期化学第2問ii



講義について 山口大学 工学部 応用化学科
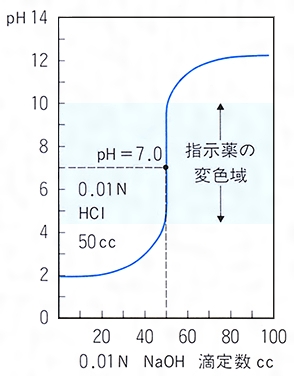



滴定とは コトバンク




キレート滴定 Yakugaku Lab




最も欲しかった キレート滴定 考察 書き方 キレート滴定 考察 書き方 Mbaheblogjpmvvo




滴定計算 滴定についてよくある質問 定義 モル濃度方程式 曲 Lorett



1




Rec Realeducationcompany 皆さんこんにちは Rec レック です 先週に引き続き 過去の国家試験を分析した上で出題頻度の高い内容や 103回国家試験で出題されそうな内容を発信していきます 本日は 定量分析から 化学的定量法 に関して103回国家試験で出題




化学基礎計算問題の答え 教科書の問題問5と6を解いたのですが教科書 化学 教えて Goo




非水滴定の指示薬と標準液のゴロ 覚え方 薬学ゴロ 薬学部はゴロでイチコロ



水の硬度 株式会社ユニケミー ユニラボ



2



Column




化学の質問です 問題1 問題2までの物質量等の問題でわからなくて質問 化学 教えて Goo



Asahikawa Nct Ac Jp



2




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog
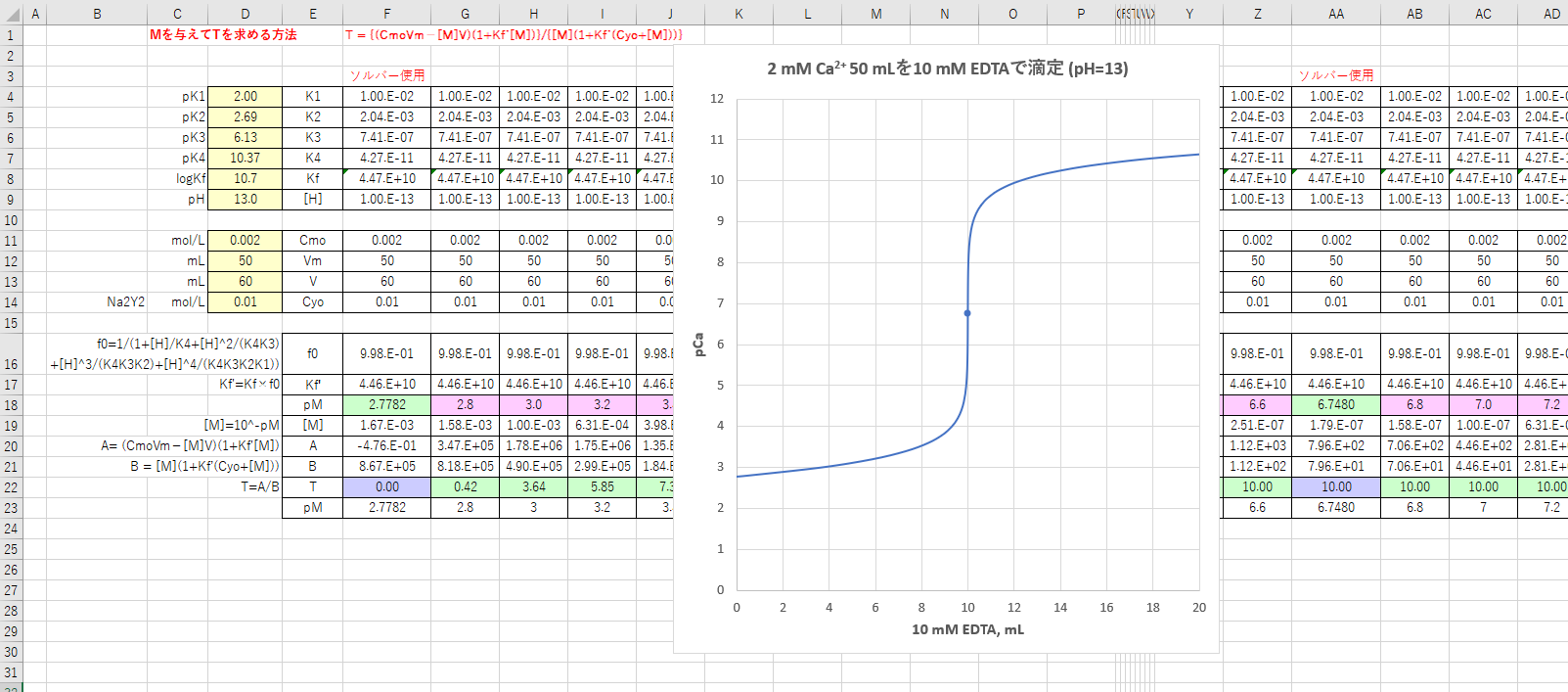



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて



工業用 アミノカルボン酸系キレート剤 Ip キレート D 特長 で長時間の加熱に対しても安定です 2 アルカリ溶液中で第二鉄イオンと反応します さらに中性溶液中では Edta の錯体より安定です 3 Fe 3 や Cu 2 に対するキレート力が強い為 過酸化物漂白浴や過




環境計量士 濃度関係 新 環境計量に関する基礎知識 解説と対策 化学 コロナ社



キレート滴定 Yakugaku Lab



基礎から学ぶ分析化学 株式会社 化学同人




書籍紹介 分析化学の基礎 木村 優 中島理一郎 共著 化学



2




キレート滴定 Yakugaku Lab



W Atwiki Jp



2




逆滴定の計算問題の解法 アンモニアと二酸化炭素の4パターンとは 化学受験テクニック塾



キレート滴定についてです 現在高校生で 個人的な理由で Yahoo 知恵袋



キレート滴定 Yakugaku Lab



水の硬度測定



2



水の硬度測定 キレート滴定



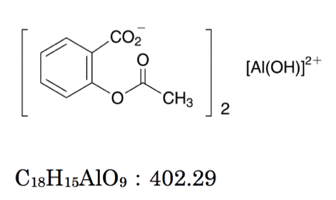
エチレンジアミン四酢酸 Edta に関する記述 104回薬剤師国家試験問100




最も欲しかった キレート滴定 考察 書き方 キレート滴定 考察 書き方 Mbaheblogjpmvvo




錯体 キレート 錯体平衡の計算問題を解いてみよう 演習問題



2



キレート滴定の濃度計算問題についてです 解き方がわからないので 教えていただ Yahoo 知恵袋



Bunseki Ac Jp




京都大学 化学実験操作法 操作法 2 4 キレート滴定 Mg イオンの定量 Youtube



2




Paypayフリマ 送料無料 薬学生 計算問題集



Kuchem Kyoto U Ac Jp




アプリの紹介 キレート滴定曲線 車輪の再発見みたいな
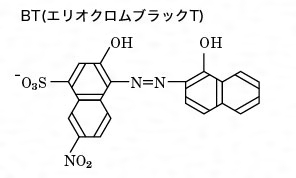



キレート滴定とは コトバンク



2




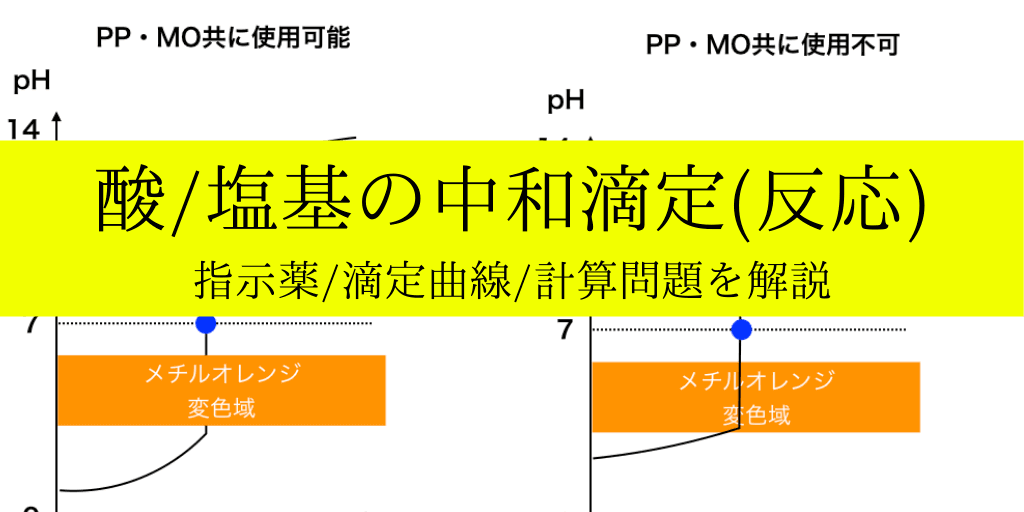
中和滴定 滴定曲線 指示薬と計算問題の解き方をまとめて解説



化学キレート滴定の問題です 赤線引いたところの意味がわかりません Yahoo 知恵袋



水の分析



中和滴定 滴定曲線 指示薬と計算問題の解き方をまとめて解説




滴定計算 滴定についてよくある質問 定義 モル濃度方程式 曲 Lorett



キレート わかりやすく




薬学 必須問題集 18年の通販 By Nozomi S Shop ラクマ
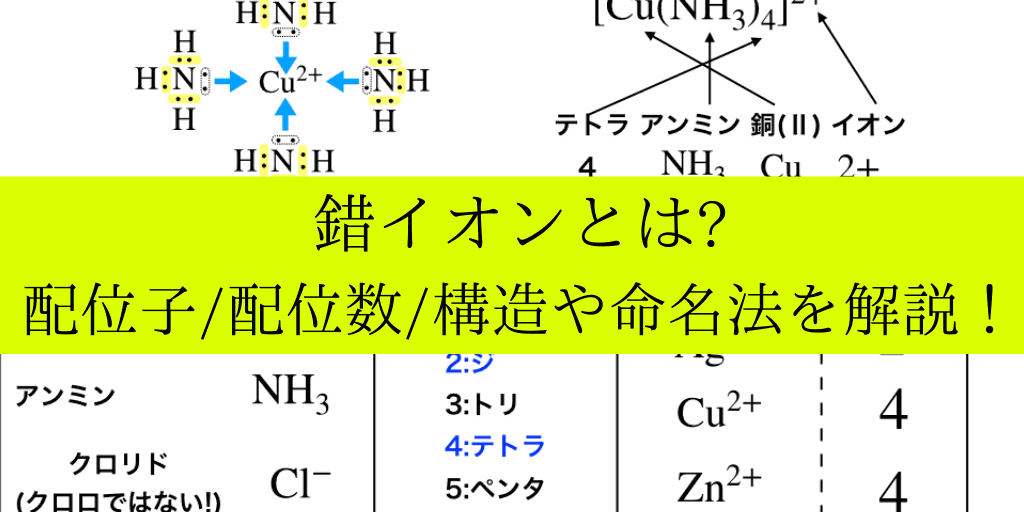



錯イオンとは 命名法や構造 配位子などの意味 覚え方まで詳しく解説




滴定計算 滴定についてよくある質問 定義 モル濃度方程式 曲 Lorett




Gre Chemistry Chem Station ケムステ
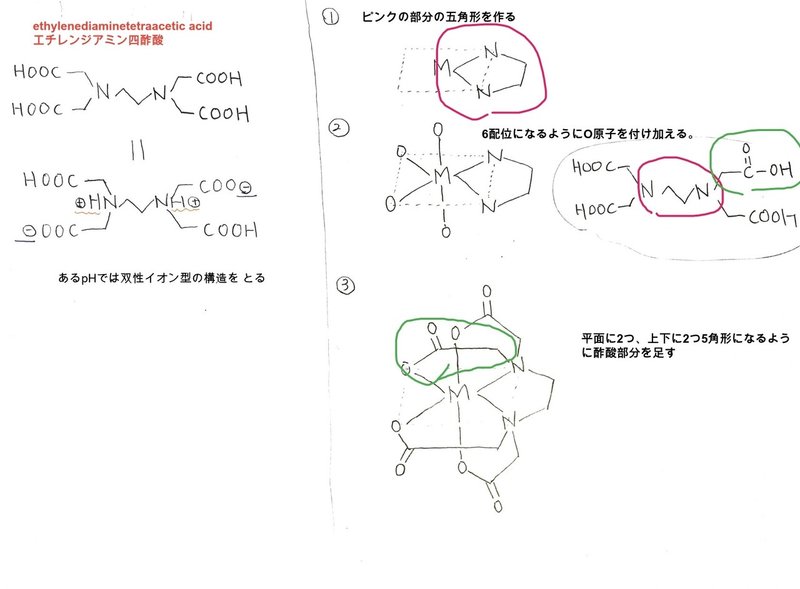



Edtaってなに 覚え方のコツなど Yotto Note




キレート滴定 Yakugaku Lab




17 号 キレート剤の定量方法 Astamuse



1



2
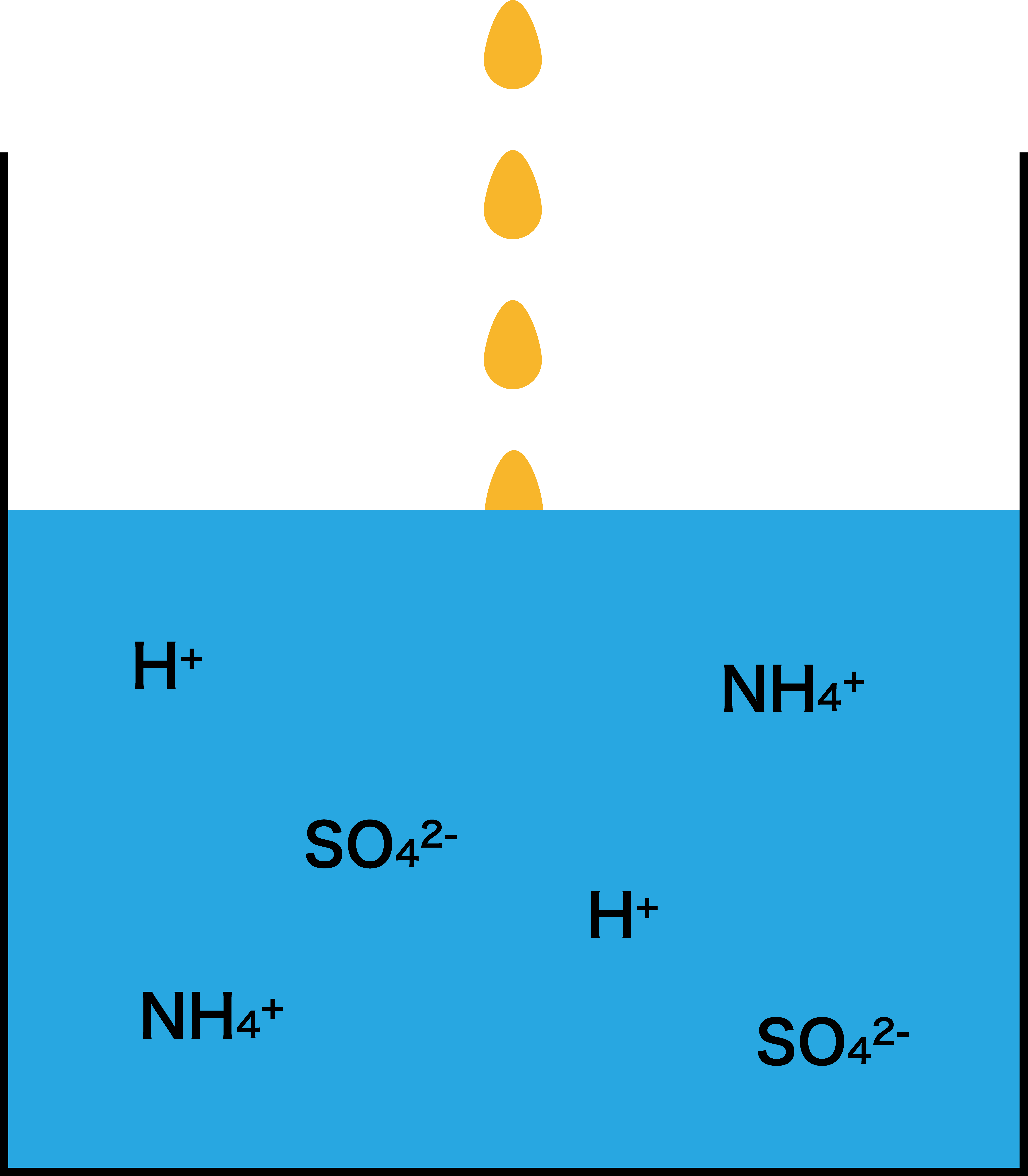



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ
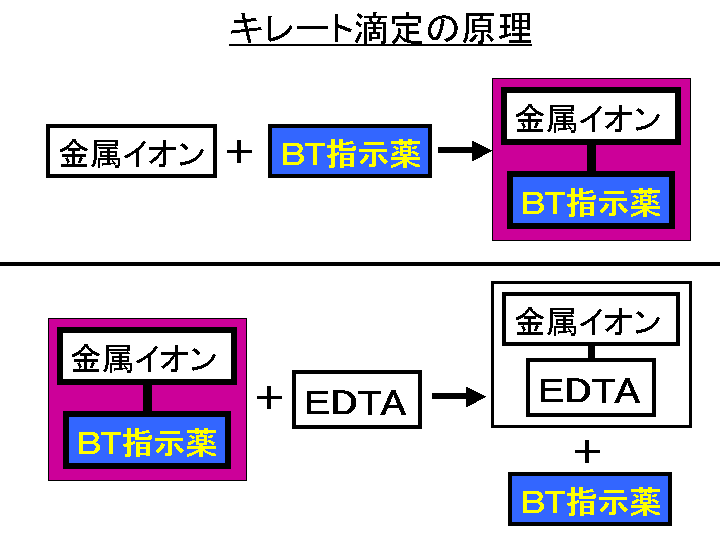



水の硬度測定 キレート滴定
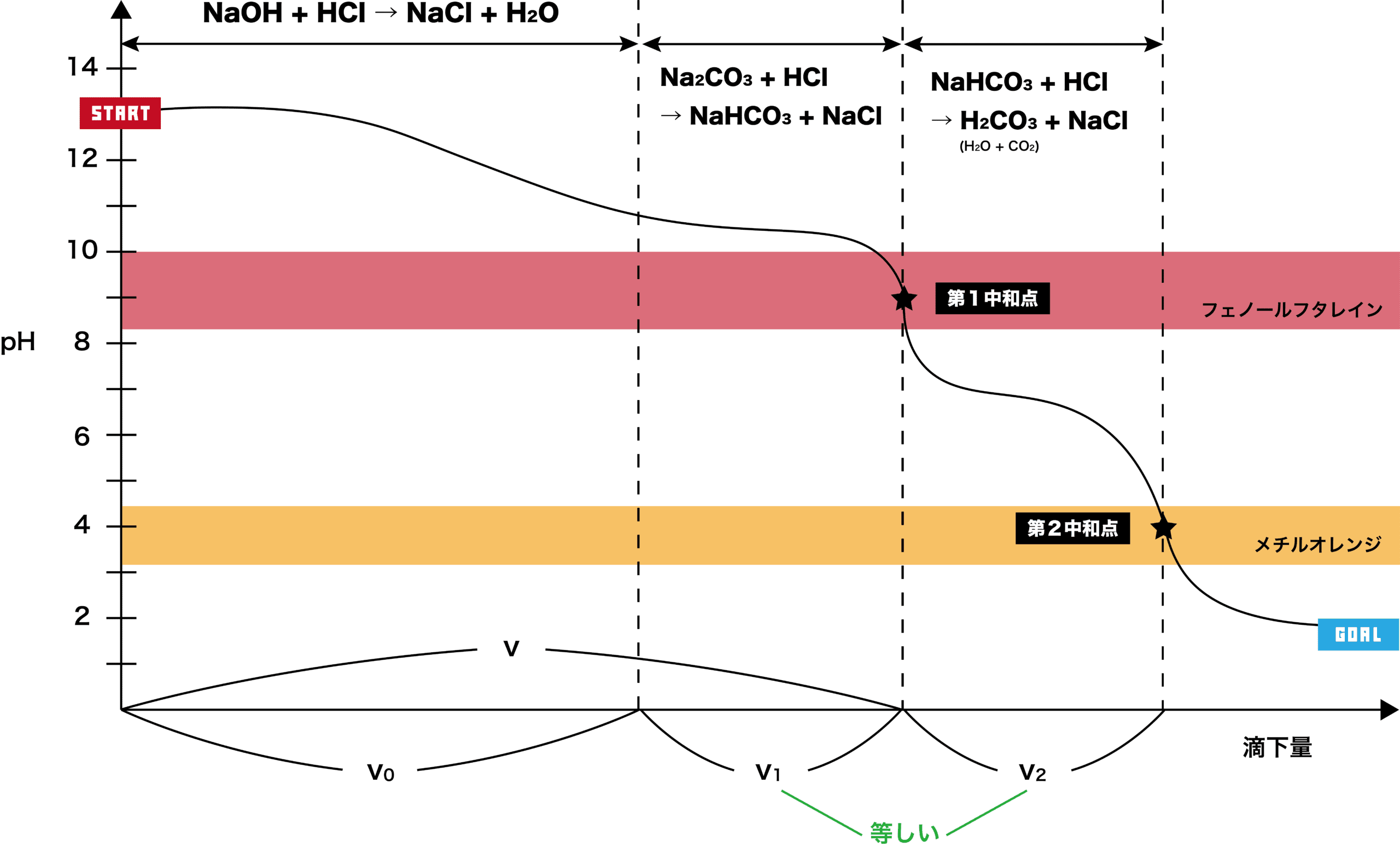



二段滴定 原理 例題 計算問題の解き方など 化学のグルメ
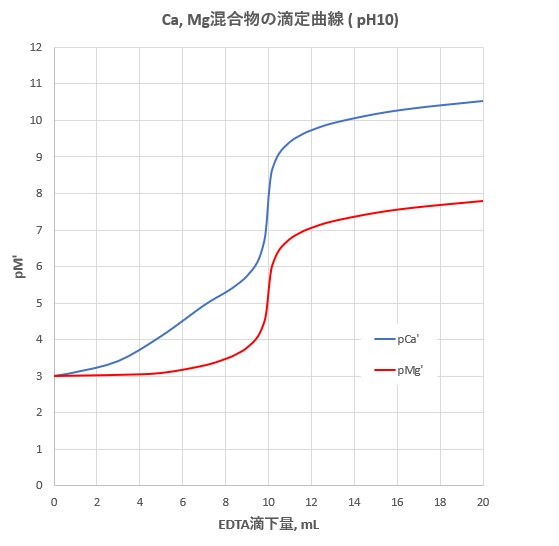



Edta滴定によるcaおよびmgの分別定量 滴定曲線 溶解度などーエクセルを用いて



2



2



カルシウムキレート剤 脳科学辞典



0 件のコメント:
コメントを投稿